Moderni PRP: "Klininen PRP"
Viimeisten 10 vuoden aikana PRP:n hoitojärjestelmä on kokenut suuria muutoksia.Kokeellisen ja kliinisen tutkimuksen ansiosta meillä on nyt parempi käsitys verihiutaleiden ja muiden solujen fysiologiasta.Lisäksi useat korkealaatuiset systemaattiset arvioinnit, meta-analyysit ja satunnaistetut kontrolloidut kokeet ovat osoittaneet PRP-biotekniikan tehokkuuden monilla lääketieteen aloilla, mukaan lukien ihotauti, sydänkirurgia, plastiikkakirurgia, ortopedinen kirurgia, kivunhallinta, selkärangan sairaudet ja urheilulääketiede. .
PRP:n tämänhetkinen ominaisuus on sen absoluuttinen verihiutaleiden pitoisuus, joka muuttuu PRP:n alkuperäisestä määritelmästä (mukaan lukien verihiutaleiden pitoisuus perusarvoa korkeammalla) yli 1 × 10 6/µL tai noin 5 kertaa verihiutaleiden vähimmäispitoisuus verihiutaleissa perusviiva.Laajassa katsauksessa Fadadu et al.33 PRP-järjestelmää ja protokollaa arvioitiin.Joidenkin näistä järjestelmistä tuottaman lopullisen PRP-valmisteen verihiutaleiden määrä on pienempi kuin kokoveren.He raportoivat, että PRP:n verihiutaletekijä nousi niinkin alas kuin 0,52 single spin kit (Selphyl®) avulla.Sitä vastoin kaksoiskierto EmCyte Genesis PurePRPII ® Laitteen tuottama verihiutalepitoisuus on korkein (1,6 × 10 6 /µL) .
On selvää, että in vitro ja eläinmenetelmät eivät ole ihanteellinen tutkimusympäristö onnistuneelle siirtymiselle kliiniseen käytäntöön.Samoin laitevertailututkimus ei tue päätöstä, koska ne osoittavat, että verihiutaleiden pitoisuus PRP-laitteiden välillä on hyvin erilainen.Onneksi proteomiikkaan perustuvan teknologian ja analyysin avulla voimme lisätä ymmärrystämme PRP:n solutoiminnoista, jotka vaikuttavat hoitotuloksiin.Ennen kuin päästään yksimielisyyteen standardoiduista PRP-valmisteista ja -formulaatioista, PRP:n tulee noudattaa kliinisiä PRP-formulaatioita merkittävien kudosten korjausmekanismien ja progressiivisten kliinisten tulosten edistämiseksi.
Kliininen PRP-kaava
Tällä hetkellä tehokas kliininen PRP (C-PRP) on luonnehdittu autologisten monisoluisten komponenttien monimutkaiseksi koostumukseksi pienitilavuuksisessa plasmassa, joka on saatu osasta perifeeristä verta sentrifugoinnin jälkeen.Sentrifugoinnin jälkeen PRP ja sen ei-verihiutalesolukomponentit voidaan ottaa talteen väkevöintilaitteesta eri solutiheyksien mukaan (joista verihiutaleiden tiheys on pienin).
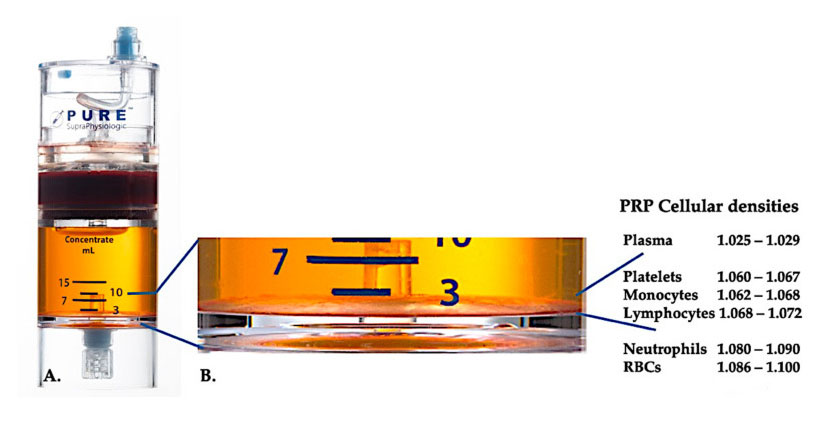
Käytä PurePRP-SP® Solutiheyden erotuslaitteistoa (EmCyte Corporation, Fort Myers, FL, USA) käytettiin kokovereen kahden sentrifugointitoimenpiteen jälkeen.Ensimmäisen sentrifugointiprosessin jälkeen kokoverikomponentti erotettiin kahteen peruskerrokseen, verihiutaleiden (laihaan) plasmasuspensioon ja punasolukerrokseen.A:ssa toinen sentrifugointivaihe on saatu päätökseen.Todellinen PRP-tilavuus voidaan poimia potilaan käyttöä varten.B:n suurennus osoittaa, että laitteiston pohjassa on organisoitu monikomponenttinen erytrosyyttien sedimentaation ruskea kerros (esitetty sinisellä viivalla), joka sisältää tiheysgradientin perusteella korkeita pitoisuuksia verihiutaleita, monosyyttejä ja lymfosyyttejä.Tässä esimerkissä C-PRP:n valmistusprotokollan mukaisesti, jossa neutrofiilit ovat vähäisiä, neutrofiilien (<0,3 %) ja punasolujen (<0,1 %) vähimmäisprosenttiosuus uutetaan.
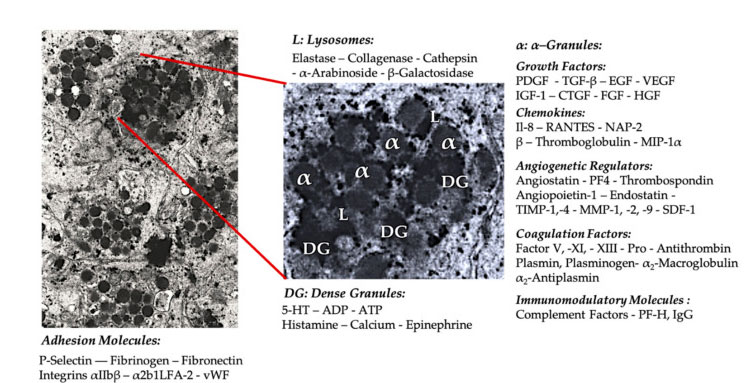
Verihiutalerakeet
Varhaisessa kliinisessä PRP-sovelluksessa α-rakeet ovat yleisimmin mainittu verihiutaleiden sisäinen rakenne, koska ne sisältävät hyytymistekijöitä, suuren määrän PDGF:ää ja angiogeenisiä säätelyaineita, mutta niillä on vähän trombogeenista toimintaa.Muita tekijöitä ovat vähemmän tunnetut kemokiini- ja sytokiinikomponentit, kuten verihiutaletekijä 4 (PF4), verihiutaleiden edeltävä emäksinen proteiini, P-selektiini (integriinin aktivaattori) ja kemokiini RANTES (säädelty aktivoimalla, ilmentävät normaaleja T-soluja ja oletettavasti erittävä).Näiden spesifisten verihiutalerakeiden komponenttien yleisenä tehtävänä on värvätä ja aktivoida muita immuunisoluja tai indusoida endoteelisolutulehdus.
Tiheitä rakeisia komponentteja, kuten ADP:tä, serotoniinia, polyfosfaattia, histamiinia ja adrenaliinia, käytetään epäsuorammin verihiutaleiden aktivaation ja tromboosin säätelijöinä.Mikä tärkeintä, monilla näistä elementeistä on immuunisolujen modifiointitehtävä.P2Y12ADP-reseptori tunnistaa verihiutaleiden ADP:n dendriittisoluissa (DC), mikä lisää antigeenien endosytoosia.DC (antigeeniä esittelevä solu) on erittäin tärkeä T-solujen immuunivasteen käynnistämisessä ja suojaavan immuunivasteen hallinnassa, joka yhdistää synnynnäisen immuunijärjestelmän ja adaptiivisen immuunijärjestelmän.Lisäksi verihiutaleiden adenosiinitrifosfaatti (ATP) lähettää signaaleja T-solureseptorin P2X7 kautta, mikä johtaa CD4 T-auttajasolujen lisääntyneeseen erilaistumiseen tulehdusta edistäviksi T-auttaja-17 (Th17) -soluiksi.Muut verihiutaletiheät raekomponentit (kuten glutamaatti ja serotoniini) indusoivat T-solujen migraatiota ja lisäävät monosyyttien erilaistumista DC:ksi, vastaavasti.PRP:ssä nämä tiheistä partikkeleista johdetut immunomodulaattorit ovat erittäin rikastettuja ja niillä on merkittäviä immuunitoimintoja.
Verihiutaleiden ja muiden (reseptori)solujen välisten suorien ja epäsuorien vuorovaikutusten määrä on laaja.Siksi PRP:n käyttö paikallisessa patologisessa kudosympäristössä voi aiheuttaa erilaisia tulehduksellisia vaikutuksia.
Verihiutaleiden keskittyminen
C-PRP:n tulee sisältää kliinisiä annoksia konsentroituja verihiutaleita hyödyllisten terapeuttisten vaikutusten aikaansaamiseksi.C-PRP:ssä olevien verihiutaleiden pitäisi stimuloida solujen lisääntymistä, mesenkymaalisten ja neurotrofisten tekijöiden synteesiä, edistää kemotaktisten solujen migraatiota ja stimuloida immunosäätelyaktiivisuutta, kuten kuvassa esitetään.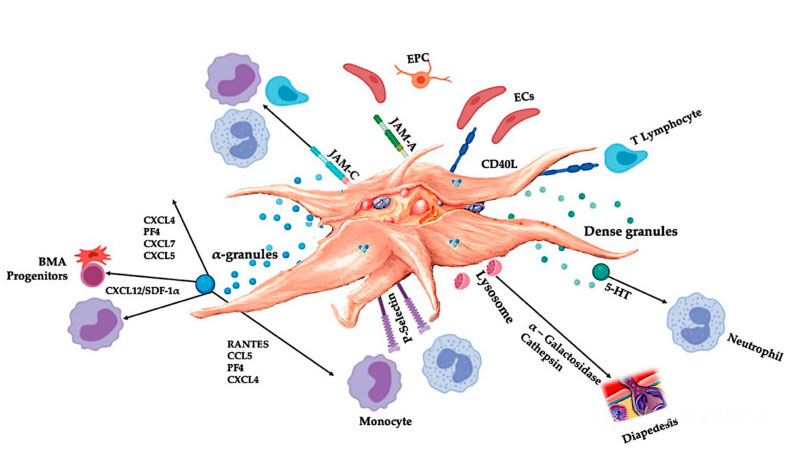
Aktivoidut verihiutaleet, PGF:n vapautuminen ja adheesiomolekyylit välittävät erilaisia soluvuorovaikutuksia: kemotaksista, soluadheesiota, migraatiota ja solujen erilaistumista ja säätelevät immuunijärjestelmän säätelytoimintoja.Nämä verihiutalesolu-soluvuorovaikutukset edistävät angiogeneesiä ja tulehdusaktiivisuutta ja viime kädessä stimuloivat kudosten korjausprosessia.Lyhenteet: BMA: luuytimen aspiraatti, EPC: endoteelisolut, EC: endoteelisolut, 5-HT: 5-hydroksitryptamiini, RANTES: normaalin T-solujen ilmentymisen ja oletetun erityksen aktivoitu säätely, JAM: liitosadheesiomolekyylityyppi, CD40L: klusteri 40 ligandi, SDF-1 α: Stromaalisista soluista peräisin oleva tekijä-1 α, CXCL: kemokiini (CXC-motiivi) ligandi, PF4: verihiutaletekijä 4. Mukautettu julkaisusta Everts et ai.
Marx oli ensimmäinen henkilö, joka osoitti, että luun ja pehmytkudosten paraneminen tehostui, ja verihiutaleiden vähimmäismäärä oli 1 × 10 6 /µL. Nämä tulokset vahvistettiin tutkimuksessa, joka koski lannerangan fuusiota nikamien välisen aukon kautta, kun verihiutaleiden annos oli suurempi kuin 1,3 × 106 verihiutaletta/µl tämä tutkimus osoitti enemmän fuusiota.Lisäksi Giusti et ai.Paljastui 1,5 × Kudosten korjausmekanismi annoksella 109 vaatii verihiutaleita/ml indusoidakseen toiminnallisen angiogeneesin endoteelisolujen aktiivisuuden kautta.Jälkimmäisessä tutkimuksessa korkeammat pitoisuudet vähensivät verihiutaleiden angiogeneesipotentiaalia follikkeleissa ja niiden ympärillä.Lisäksi aikaisemmat tiedot osoittivat, että PRP:n annos vaikuttaisi myös hoitotuloksiin.Siksi angiogeneesireaktion indusoimiseksi merkittävästi ja solujen proliferaation ja solujen migraation stimuloimiseksi C-PRP:n tulisi sisältää vähintään 7,5 5 ml:n PRP-hoitopullossa × 10 9 voi kuljettaa verihiutaleita.
Annosriippuvuuden lisäksi PRP:n vaikutus solujen aktiivisuuteen näyttää olevan erittäin aikariippuvainen.Sophie et ai.Nämä tulokset viittaavat siihen, että lyhytaikainen altistuminen ihmisen verihiutalelysaateille voi stimuloida luusolujen lisääntymistä ja kemotaksista.Päinvastoin, pitkäaikainen altistuminen PRP:lle johtaa alhaisempiin alkalisen fosfataasin ja mineraalien muodostumisen tasoihin.
punasolu
Punasolut ovat vastuussa hapen kuljettamisesta kudoksiin ja hiilidioksidin siirtämisestä kudoksista keuhkoihin.Niissä ei ole ydintä ja ne koostuvat proteiineihin sitoutuvista hemimolekyyleistä.Punasolujen rauta- ja hemikomponentit edistävät hapen ja hiilidioksidin yhdistelmää.Yleensä punasolujen elinkaari on noin 120 päivää.Makrofagit poistavat ne verenkierrosta punasolujen ikääntymisen prosessin kautta.PRP-näytteiden punaiset verisolut voivat vaurioitua leikkausolosuhteissa (esimerkiksi kokoveren verenvuotoleikkaus, immuunivälitteinen prosessi, oksidatiivinen stressi tai riittämätön PRP-pitoisuusjärjestelmä).Siksi punasolujen kalvo hajoaa ja vapauttaa myrkyllistä hemoglobiinia (Hb), mitattuna plasmavapaalla hemoglobiinilla (PFH), heemillä ja raudalla.].PFH ja sen hajoamistuotteet (hemi ja rauta) johtavat yhdessä haitallisiin ja sytotoksisiin vaikutuksiin kudoksissa, mikä johtaa oksidatiiviseen stressiin, typpioksidin häviämiseen, tulehdusreittien aktivoitumiseen ja immunosuppressioon.Nämä vaikutukset johtavat lopulta mikroverenkierron toimintahäiriöön, paikalliseen vasokonstriktioon ja verisuonivaurioon sekä vakaviin kudosvaurioihin.
Tärkeintä on, että kun C-PRP:tä sisältäviä punasoluja kuljetetaan kudokseen, se aiheuttaa paikallisen reaktion nimeltä eryptoosi, joka laukaisee tehokkaan sytokiinin ja makrofagien migraation estäjän vapautumisen.Tämä sytokiini estää monosyyttien ja makrofagien migraatiota.Se kohdistaa voimakkaita pro-inflammatorisia signaaleja ympäröiviin kudoksiin, estää kantasolujen migraatiota ja fibroblastien lisääntymistä ja johtaa merkittäviin paikallisiin solujen toimintahäiriöihin.Siksi on tärkeää rajoittaa PRP-valmisteiden punasolukontaminaatiota.Lisäksi punasolujen roolia kudosten uudistamisessa ei ole koskaan määritetty.Riittävä C-PRP-sentrifugointi ja valmistusprosessi yleensä vähentää tai jopa eliminoi punasolujen esiintymisen, jolloin vältetään hemolyysin ja polysytemian haitalliset seuraukset.
Leukosyytit C-PRP:ssä
Valkosolujen esiintyminen PRP-valmisteissa riippuu hoitolaitteistosta ja valmistussuunnitelmasta.Plasmapohjaisissa PRP-laitteissa valkosolut eliminoidaan kokonaan;Kuitenkin valkosolut keskittyivät merkittävästi erytrosyyttien sedimentaatioruskean kerroksen PRP-valmisteeseen.Immuuni- ja isännän puolustusmekanisminsa ansiosta valkosolut vaikuttavat suuresti akuuttien ja kroonisten kudossairauksien sisäiseen biologiaan.Näitä ominaisuuksia käsitellään tarkemmin alla.Siksi spesifisten leukosyyttien läsnäolo C-PRP:ssä voi aiheuttaa merkittäviä solu- ja kudosvaikutuksia.Tarkemmin sanottuna erilaiset PRP-erytrosyyttien sedimentaation ruskea-keltaiset kerrosjärjestelmät käyttävät erilaisia valmistusmenetelmiä, tuottaen siten eri osuuden neutrofiilejä, lymfosyyttejä ja monosyyttejä PRP:ssä.Eosinofiilejä ja basofiilejä ei voida mitata PRP-valmisteista, koska niiden solukalvot ovat liian hauraita kestämään keskipakoprosessointivoimia.
Neutrofiilit
Neutrofiilit ovat välttämättömiä leukosyyttejä monissa paranemisreiteissä.Nämä reitit yhdistyvät verihiutaleissa olevien antimikrobisten proteiinien kanssa muodostaen tiheän esteen invasiivisia patogeenejä vastaan.Neutrofiilien olemassaolo määritetään C-PRP:n hoitokohteen mukaan.Lisääntynyt kudostulehdus voi olla tarpeen kroonisen haavanhoidon PRP-bioterapiassa tai luun kasvuun tai paranemiseen tähtäävissä sovelluksissa.Tärkeää on, että useista malleista on löydetty lisää neutrofiilitoimintoja, jotka korostavat niiden roolia angiogeneesissä ja kudosten korjaamisessa.Neutrofiilit voivat kuitenkin aiheuttaa myös haitallisia vaikutuksia, joten ne eivät sovellu joihinkin sovelluksiin.Zhou ja Wang osoittivat, että runsaasti neutrofiilejä sisältävän PRP:n käyttö voi lisätä tyypin III kollageenin ja tyypin I kollageenin suhdetta, mikä pahentaa fibroosia ja vähentää jänteiden vahvuutta.Muita neutrofiilien välittämiä haitallisia ominaisuuksia ovat tulehduksellisten sytokiinien ja matriksin metalloproteinaasien (MMP) vapautuminen, jotka voivat edistää tulehdusta ja kataboliaa kudoksiin levitettynä.
Leukomonosyytti
C-PRP:ssä mononukleaariset T- ja B-lymfosyytit ovat keskittyneempiä kuin muut valkosolut.Ne liittyvät läheisesti soluvälitteiseen sytotoksiseen adaptiiviseen immuniteettiin.Lymfosyytit voivat laukaista solureaktioita torjuakseen infektioita ja mukautuakseen hyökkääjiin.Lisäksi T-lymfosyyteistä peräisin olevat sytokiinit (interferoni-γ [IFN-γ] ja interleukiini-4 (IL-4) tehostavat makrofagien polarisaatiota. Verassar et al. On todistettu, että tavanomaiset T-lymfosyytit voivat epäsuorasti edistää kudosten paranemista hiirimalli säätelemällä monosyyttien ja makrofagien erilaistumista.
Monosyytti – monipotentti korjaussolu
Käytetyn PRP-valmistuslaitteen mukaan monosyyttejä voi esiintyä PRP-käsittelypullossa tai niitä ei ole.Valitettavasti niiden suorituskykyä ja uusiutumiskykyä käsitellään harvoin kirjallisuudessa.Siksi monosyytteihin kiinnitetään vain vähän huomiota valmistusmenetelmässä tai lopullisessa kaavassa.Monosyyttiryhmä on heterogeeninen, peräisin luuytimessä olevista progenitorisoluista ja kuljetettu perifeerisiin kudoksiin hematopoieettisen kantasolureitin kautta mikroympäristöstimulaation mukaisesti.Homeostaasin ja tulehduksen aikana kiertävät monosyytit poistuvat verenkierrosta ja rekrytoidaan vaurioituneisiin tai hajotettuihin kudoksiin.Ne voivat toimia makrofageina (M Φ) efektorisoluina tai progenitorisoluina.Monosyytit, makrofagit ja dendriittisolut edustavat mononukleaarista fagosyyttijärjestelmää (MPS). MPS:n tyypillinen piirre on sen geeniekspressiomallin plastisuus ja näiden solutyyppien toiminnallinen päällekkäisyys.Degeneroituneissa kudoksissa pysyvät makrofagit, paikallisesti vaikuttavat kasvutekijät, tulehdusta edistävät sytokiinit, apoptoottiset tai nekroottiset solut ja mikrobituotteet käynnistävät monosyytit erilaistumaan MPS-soluryhmiksi.Oletetaan, että kun C-PRP:tä sisältäviä korkeatuottoisia monosyyttejä injektoidaan taudin paikalliseen mikroympäristöön, monosyytit todennäköisesti erilaistuvat M Φ:ksi aiheuttaakseen suuria solumuutoksia.
Monosyytistä M Φ Transformaatioprosessissa spesifinen M Φ Fenotyyppi.Viimeisten kymmenen vuoden aikana on kehitetty malli, joka integroi M Φ Monimutkainen aktivaatiomekanismi kuvataan kahden vastakkaisen tilan polarisaatioksi: M Φ Fenotyyppi 1 (M Φ 1, Klassinen aktivaatio) ja M Φ Fenotyyppi 2 (M Φ 2, vaihtoehtoinen aktivointi).MΦ 1:lle on tunnusomaista tulehduksellinen sytokiinieritys (IFN-γ) ja typpioksidi tehokkaan patogeenien tappamismekanismin tuottamiseksi.M Φ Fenotyyppi tuottaa myös verisuonten endoteelikasvutekijää (VEGF) ja fibroblastikasvutekijää (FGF).M Φ Fenotyyppi koostuu anti-inflammatorisista soluista, joilla on korkea fagosytoosi.M Φ 2 Tuottaa solunulkoisia matriisikomponentteja, angiogeneesiä ja kemokiineja sekä interleukiini 10:tä (IL-10).Patogeenin suojan lisäksi M Φ Se voi myös vähentää tulehdusta ja edistää kudosten paranemista.On huomionarvoista, että M Φ 2 on jaettu M in vitro Φ 2a、M Φ 2b ja M Φ 2:ksi. Se riippuu ärsykkeestä.Näiden alatyyppien translaatio in vivo on vaikeaa, koska kudos voi sisältää sekalaisia MΦ-ryhmiä.Mielenkiintoista on, että paikallisten ympäristösignaalien ja IL-4-tasojen perusteella tulehdusta edistävä M Φ 1 voidaan muuntaa edistämään korjausta M Φ 2. Näiden tietojen perusteella on kohtuullista olettaa, että monosyyttien ja M Φ C-PRP -valmisteiden pitoisuudet ovat korkeat. voivat edistää parempaa kudosten korjausta, koska niillä on anti-inflammatorinen kudosten korjaus- ja solusignaalinsiirtokyky.
Valkosolufraktion hämmentynyt määritelmä PRP:ssä
Valkosolujen esiintyminen PRP-hoitopulloissa riippuu PRP:n valmistuslaitteesta ja voi olla merkittäviä eroja.Leukosyyttien olemassaolosta ja niiden vaikutuksesta erilaisiin PRP-tuotteisiin (kuten PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF ja L-PRF) on äskettäin tehdyssä katsauksessa kuusi satunnaistettua kiistaa. kontrolloiduissa tutkimuksissa (näyttöaste 1) ja kolmessa prospektiivisessä vertailututkimuksessa (todentamistaso 2) oli mukana 1055 potilasta, mikä osoittaa, että LR-PRP:n ja LP-PRP:n turvallisuus oli samanlainen.Kirjoittaja päätteli, että PRP:n haittavaikutus ei välttämättä liity suoraan valkosolujen pitoisuuteen.Toisessa tutkimuksessa LR-PRP ei muuttanut tulehduksellista interleukiinia (IL-1) OA-polven β、 IL-6:ssa, IL-8:ssa ja IL-17:ssä).Nämä tulokset tukevat näkemystä, että leukosyyttien rooli PRP:n biologisessa aktiivisuudessa in vivo voi johtua verihiutaleiden ja leukosyyttien välisestä ylikuulumisesta.Tämä vuorovaikutus voi edistää muiden tekijöiden (kuten lipohapen) biosynteesiä, mikä voi kompensoida tai edistää tulehduksen regressiota.Tulehduksellisten molekyylien (arakidonihappo, leukotrieeni ja prostaglandiini) ensimmäisen vapautumisen jälkeen lipoppi A4 vapautuu aktivoiduista verihiutaleista neutrofiilien aktivoitumisen estämiseksi.Juuri tässä ympäristössä M Φ fenotyyppi M Φ 1:stä vaihtaa M Φ 2:ksi. Lisäksi on yhä enemmän todisteita siitä, että kiertävät mononukleaariset solut voivat erilaistua useiksi ei-fagosyyttisiksi solutyypeiksi niiden pluripotenssin vuoksi.
PRP:n tyyppi vaikuttaa MSC-viljelyyn.Verrattuna puhtaisiin PRP- tai PPP-näytteisiin, LR-PRP voi indusoida merkittävästi korkeamman luuytimestä peräisin olevien MSC:iden (BMMSC:iden) lisääntymisen nopeammalla vapautumisella ja paremmalla PGF:n biologisella aktiivisuudella.Kaikki nämä ominaisuudet edistävät monosyyttien lisäämistä PRP-hoitopulloon ja niiden immunomodulatoristen kykyjen ja erilaistumispotentiaalin tunnistamista.
Synnynnäinen ja adaptiivinen PRP:n immuunisäätö
Verihiutaleiden tunnetuin fysiologinen tehtävä on verenvuodon hallinta.Ne kerääntyvät kudosvauriokohtaan ja vaurioituneisiin verisuoniin.Nämä tapahtumat johtuvat integriinien ja selektiinien ilmentymisestä, jotka stimuloivat verihiutaleiden adheesiota ja aggregaatiota.Vaurioitunut endoteeli pahentaa tätä prosessia entisestään, ja paljastunut kollageeni ja muut subendoteliaaliset matriisiproteiinit edistävät verihiutaleiden syvää aktivoitumista.Näissä tapauksissa von Willebrand -tekijän (vWF) ja glykoproteiinin (GP), erityisesti GP-Ib:n, välisen vuorovaikutuksen tärkeä rooli on todistettu.Verihiutaleaktivaation jälkeen verihiutale α-、 Tiheät, lysosomi- ja T-rakeet säätelevät eksosytoosia ja vapauttavat sisältönsä solunulkoiseen ympäristöön.
Verihiutaleiden adheesiomolekyyli
Ymmärtääksemme paremmin PRP:n roolia tulehduksellisissa kudoksissa ja verihiutaleissa immuunivasteessa, meidän tulisi ymmärtää, kuinka erilaiset verihiutaleiden pintareseptorit (integriinit) ja liitosadheesiomolekyylit (JAM) ja soluvuorovaikutukset voivat käynnistää kriittisiä prosesseja synnynnäisessä ja adaptiivisessa immuniteetissa.
Integriinit ovat solun pintaadheesiomolekyylejä, joita löytyy eri solutyypeistä ja jotka ilmentyvät suuria määriä verihiutaleissa.Integriineihin kuuluvat a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) ja aIIbb3 (GPIIb/IIIa).Yleensä ne ovat staattisessa ja alhaisen affiniteetin tilassa.Aktivoinnin jälkeen ne siirtyvät korkean ligandin sitoutumisaffiniteetin tilaan.Integriineillä on erilaisia tehtäviä verihiutaleissa ja ne osallistuvat verihiutaleiden vuorovaikutukseen useiden erityyppisten valkosolujen, endoteelisolujen ja solunulkoisen matriisin kanssa.Lisäksi GP-Ib-V-IX-kompleksi ilmentyy verihiutalekalvolla ja on pääreseptori sitoutumiselle von vWF:ään.Tämä vuorovaikutus välittää verihiutaleiden ja paljastuneiden subendoteliaalisten rakenteiden välistä alkukontaktia.Verihiutaleiden integriini ja GP-kompleksi liittyvät erilaisiin tulehdusprosesseihin ja niillä on tärkeä rooli verihiutale-leukosyyttikompleksin muodostumisessa.Erityisesti integriini aIIbb3 on välttämätön stabiilin kompleksin muodostamiseksi yhdistämällä fibrinogeeni neutrofiilien makrofagi 1 -antigeenireseptorin (Mac-1) kanssa.
Verihiutaleet, neutrofiilit ja verisuonten endoteelisolut ilmentävät spesifisiä soluadheesiomolekyylejä, joita kutsutaan selektiiniksi.Tulehduksellisissa olosuhteissa verihiutaleet ekspressoivat P-selektiiniä ja neutrofiilien L-selektiiniä.Verihiutaleiden aktivaation jälkeen P-selektiini voi sitoutua ligandiin PSGL-1, joka esiintyy neutrofiileissä ja monosyyteissä.Lisäksi PSGL-1:n sitoutuminen käynnistää solunsisäisen signaalikaskadireaktion, joka aktivoi neutrofiilit neutrofiiliintegriini Mac-1:n ja lymfosyyttien toimintaan liittyvän antigeenin 1:n (LFA-1) kautta.Aktivoitu Mac-1 sitoutuu verihiutaleissa olevaan GPIb:hen tai GPIIb/IIIa:han fibrinogeenin kautta, mikä stabiloi neutrofiilien ja verihiutaleiden välistä vuorovaikutusta.Lisäksi aktivoitu LFA-1 voi yhdistyä verihiutaleiden solujen välisen adheesiomolekyylin 2 kanssa stabiloimaan edelleen neutrofiili-verihiutalekompleksia, mikä edistää pitkäaikaista adheesiota solujen kanssa.
Verihiutaleilla ja leukosyyteillä on keskeinen rooli synnynnäisissä ja adaptiivisissa immuunivasteissa
Keho voi tunnistaa vieraita esineitä ja vaurioituneita kudoksia akuuteissa tai kroonisissa sairauksissa käynnistääkseen haavan paranemiskaskadireaktion ja tulehdusreitin.Synnynnäinen ja mukautuva immuunijärjestelmä suojaa isäntää infektioilta, ja valkosoluilla on tärkeä rooli näiden kahden järjestelmän päällekkäisyydessä.Erityisesti monosyyteillä, makrofageilla, neutrofiileillä ja luonnollisilla tappajasoluilla on keskeinen rooli synnynnäisessä järjestelmässä, kun taas lymfosyyteillä ja niiden alajoukoilla on samanlainen rooli adaptiivisessa immuunijärjestelmässä.
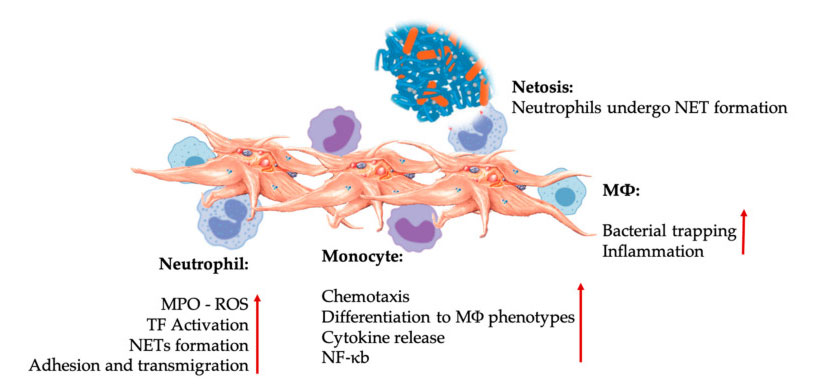
Verihiutaleiden ja leukosyyttien vuorovaikutukset synnynnäisissä immuunisoluvuorovaikutuksissa.Verihiutaleet ovat vuorovaikutuksessa neutrofiilien ja monosyyttien kanssa ja lopuksi M Φ Vuorovaikuttavat, säätävät ja lisäävät niiden efektoritoimintoja.Nämä verihiutale-leukosyyttivuorovaikutukset johtavat tulehdukseen erilaisten mekanismien kautta, mukaan lukien NEToosi.Lyhenteet: MPO: myeloperoksidaasi, ROS: reaktiiviset happilajit, TF: kudostekijä, NET: neutrofiilien ekstrasellulaarinen ansa, NF-κ B: ydintekijä kappa B, M Φ: Makrofagit.
Synnynnäinen immuunijärjestelmä
Synnynnäisen immuunijärjestelmän tehtävänä on tunnistaa epäspesifisesti invasiiviset mikro-organismit tai kudosfragmentit ja stimuloida niiden puhdistumaa.Kun tietyt molekyylirakenteet, joita kutsutaan pintaekspressiomallin tunnistusreseptoreiksi (PRR:t), yhdistyvät patogeeneihin liittyviin molekyylikuvioihin ja vaurioihin liittyviin molekyylikuvioihin, luontainen immuunijärjestelmä aktivoituu.PRR:itä on monenlaisia, mukaan lukien Toll-like reseptori (TLR) ja RIG-1:n kaltainen reseptori (RLR).Nämä reseptorit voivat aktivoida päätranskriptiotekijän kappa B:n (NF-κ B). Se säätelee myös monia synnynnäisen ja adaptiivisen immuunivasteen näkökohtia.Mielenkiintoista kyllä, verihiutaleet ilmentävät pinnallaan ja sytoplasmassaan myös erilaisia immunosäätelyreseptorimolekyylejä, kuten P-selektiini, transmembraaniproteiini CD40-ligandi (CD40L), sytokiinit (kuten IL-1 β、 TGF- β) ja verihiutalespesifinen TLR. Siksi verihiutaleet voivat olla vuorovaikutuksessa erilaisten immuunisolujen kanssa.
Verihiutaleiden ja valkosolujen vuorovaikutus synnynnäisessä immuniteetissa
Kun verihiutaleet tulevat verenkiertoon tai kudokseen tai tunkeutuvat niihin, verihiutaleet ovat yksi niistä soluista, jotka havaitsevat ensin endoteelivaurion ja mikrobiset patogeenit.Verihiutaleiden aggregaatio ja edistää verihiutaleiden agonistien ADP:n, trombiinin ja vWF:n vapautumista, mikä johtaa verihiutaleiden aktivaatioon ja verihiutaleiden kemokiinireseptorien C, CC, CXC ja CX3C ilmentymiseen, mikä aiheuttaa verihiutaleita infektoituneessa paikassa tai vaurioita.
Luontainen immuunijärjestelmä on geneettisesti ennalta määrätty havaitsemaan hyökkääjät, kuten virukset, bakteerit, loiset ja toksiinit tai kudoshaavat ja haavat.Se on epäspesifinen järjestelmä, koska mikä tahansa patogeeni tunnistetaan vieraaksi tai ei-omaksi ja löydetään nopeasti.Luontainen immuunijärjestelmä luottaa proteiinien ja fagosyyttien joukkoon, jotka tunnistavat patogeenien hyvin säilyneet ominaisuudet ja aktivoivat nopeasti immuunivasteen auttaakseen eliminoimaan hyökkääjät, vaikka isäntä ei olisi koskaan ollut alttiina tietyille patogeeneille.
Neutrofiilit, monosyytit ja dendriittisolut ovat yleisimpiä synnynnäisiä immuunisoluja veressä.Heidän värväämisensä on välttämätöntä riittävän varhaisen immuunivasteen saavuttamiseksi.Kun PRP:tä käytetään regeneratiivisessa lääketieteessä, verihiutaleiden ja valkosolujen vuorovaikutus säätelee tulehdusta, haavan paranemista ja kudosten korjausta.Verihiutaleissa oleva TLR-4 stimuloi verihiutaleiden ja neutrofiilien vuorovaikutusta, joka säätelee niin kutsuttua leukosyyttien oksidatiivista purkausta säätelemällä reaktiivisten happilajien (ROS) ja myeloperoksidaasin (MPO) vapautumista neutrofiileistä.Lisäksi verihiutale-neutrofiilien ja neutrofiilien degranulaation välinen vuorovaikutus johtaa neutrofiilien ekstrasellulaaristen ansojen (NET) muodostumiseen.NET:it koostuvat neutrofiilien ytimestä ja muusta neutrofiilien intrasellulaarisesta sisällöstä, joka voi siepata bakteereja ja tappaa ne NEToosin kautta.NET:ien muodostuminen on olennainen neutrofiilien tappamismekanismi.
Verihiutaleiden aktivoitumisen jälkeen monosyytit voivat siirtyä sairaisiin ja rappeutuviin kudoksiin, joissa ne suorittavat adheesiota ja erittävät tulehduksellisia molekyylejä, jotka voivat muuttaa kemotaksia ja proteolyyttisiä ominaisuuksia.Lisäksi verihiutaleet voivat indusoida monosyyttien NF-KB-aktivaation säätelemään monosyyttien efektoritoimintoa, joka on tulehdusvasteen ja immuunisolujen aktivoitumisen ja erilaistumisen avainvälittäjä.Verihiutaleet edistävät edelleen monosyyttien endogeenistä oksidatiivista purkausta fagosyyttisten patogeenien tuhoutumisen edistämiseksi.MPO:n vapautumista välittää suora vuorovaikutus verihiutale-monosyytti-CD40L-MAC-1:n välillä.Mielenkiintoista on, että kun P-selektiini aktivoi verihiutaleita akuuteissa ja kroonisissa tulehduksellisissa kudostiloissa, verihiutaleperäiset kemokiinit PF4, RANTES, IL-1 β ja CXCL-12 voivat estää monosyyttien spontaanin apoptoosin, mutta edistää niiden erilaistumista makrofageiksi.
Mukautuva immuunijärjestelmä
Kun epäspesifinen synnynnäinen immuunijärjestelmä tunnistaa mikrobi- tai kudosvaurion, spesifinen adaptiivinen immuunijärjestelmä ottaa vallan.Mukautuviin järjestelmiin kuuluvat antigeeniä sitovat B-lymfosyytit (B-solut) ja tavanomaiset T-lymfosyytit (Treg), jotka koordinoivat patogeenien puhdistumaa.T-solut voidaan karkeasti jakaa auttaja-T-soluihin (Th-solut) ja sytotoksisiin T-soluihin (Tc-solut, jotka tunnetaan myös nimellä T-tappajasolut).Th-solut jaetaan edelleen Th1-, Th2- ja Th17-soluihin, joilla on avaintoimintoja tulehduksessa.Th-solut voivat erittää proinflammatorisia sytokiinejä (esim. IFN-γ、 TNF-β) ja useita interleukiineja (esim. IL-17). Ne ovat erityisen tehokkaita estämään solunsisäisiä virus- ja bakteeri-infektioita. Th-solut stimuloivat solujen lisääntymistä ja erilaistumista Tc-solut ovat efektorisoluja, jotka voivat eliminoida kohdennettuja solunsisäisiä ja solunulkoisia mikro-organismeja ja soluja.
Mielenkiintoista on, että Th2-solut tuottavat IL-4:ää ja vaikuttavat MΦ-polarisaatioon, MΦ ohjattuun regeneraatioon MΦ2-fenotyyppiin, kun taas IFN-γMΦ muuttuvat tulehdukselliseksi MΦ1-fenotyypiksi, mikä riippuu sytokiinien annoksesta ja ajasta.Kun IL-4 on aktivoitu, MΦ2 indusoi Treg-solut erilaistumaan Th2-soluiksi ja tuottaa sitten lisää IL-4:ää (positiivinen palautesilmukka).Th-solut muuntavat MΦ:n. Fenotyyppi on suunnattu regeneratiiviseen fenotyyppiin vasteena kudosalkuperää oleville biologisille aineille.Tämä mekanismi perustuu näyttöön siitä, että Th-soluilla on merkittävä rooli tulehduksen hallinnassa ja kudosten korjaamisessa.
Verihiutale-valkosolujen vuorovaikutus adaptiivisessa immuniteetissa
Mukautuva immuunijärjestelmä käyttää antigeenispesifisiä reseptoreita ja muistaa aiemmin kohdatut patogeenit ja tuhoaa ne myöhemmin kohdatessaan isännän.Nämä mukautuvat immuunivasteet kehittyivät kuitenkin hitaasti.Konias et ai.Se osoittaa, että verihiutalekomponentti edistää riskin havaitsemista ja kudosten korjausta ja että verihiutaleiden ja leukosyyttien välinen vuorovaikutus edistää adaptiivisen immuunivasteen aktivoitumista.
Mukautuvan immuunivasteen aikana verihiutaleet edistävät monosyytti- ja makrofagivasteita DC- ja NK-solujen kypsymisen kautta, mikä johtaa spesifisiin T-solu- ja B-soluvasteisiin.Siksi verihiutalerakeiden komponentit vaikuttavat suoraan adaptiiviseen immuniteettiin ekspressoimalla CD40L:ää, molekyyliä, joka on välttämätön adaptiivisen immuunivasteen säätelylle.Verihiutaleet CD40L:n kautta eivät ainoastaan näytä roolia antigeenin esittelyssä, vaan vaikuttavat myös T-solureaktioon.Liu et ai.Havaittiin, että verihiutaleet säätelevät CD4 T-soluvastetta monimutkaisella tavalla.Tämä CD4 T-solujen alaryhmien erilainen säätely tarkoittaa, että verihiutaleet edistävät CD4 T-soluja reagoimaan tulehdusärsykkeisiin, mikä tuottaa vahvoja tulehdusta edistäviä ja anti-inflammatorisia vasteita.
Verihiutaleet säätelevät myös B-soluvälitteistä adaptiivista vastetta mikrobipatogeeneille.On hyvin tunnettua, että CD40L aktivoiduilla CD4 T-soluilla laukaisee B-solujen CD40:n tarjoten toisen signaalin, joka tarvitaan T-soluista riippuvaiseen B-lymfosyyttien aktivaatioon, myöhempään allotyyppikonversioon ja B-solujen erilaistumiseen ja lisääntymiseen.Yleisesti ottaen tulokset osoittavat selvästi verihiutaleiden erilaiset toiminnot adaptiivisessa immuniteetissa, mikä osoittaa, että verihiutaleet yhdistävät T-solujen ja B-solujen välisen vuorovaikutuksen CD40-CD40L:n kautta, mikä tehostaa T-soluista riippuvaa B-soluvastetta.Lisäksi verihiutaleet sisältävät runsaasti solun pintareseptoreita, jotka voivat edistää verihiutaleiden aktivaatiota ja vapauttaa suuren määrän tulehduksellisia ja biologisesti aktiivisia molekyylejä, jotka on varastoitu eri verihiutalehiukkasiin, mikä vaikuttaa synnynnäiseen ja adaptiiviseen immuunivasteeseen.
Verihiutaleperäisen serotoniinin laajennettu rooli PRP:ssä
Serotoniinilla (5-hydroksitryptamiini, 5-HT) on selkeä keskeinen rooli keskushermostossa, mukaan lukien kivunsietokyky.On arvioitu, että suurin osa ihmisen 5-HT:sta tuotetaan maha-suolikanavassa ja sitten verenkierron kautta, missä se imeytyy verihiutaleisiin serotoniinin takaisinoton kuljettajan kautta ja varastoituu tiheissä hiukkasissa korkeina pitoisuuksina (65 mmol/L).5-HT on hyvin tunnettu välittäjäaine ja hormoni, joka auttaa säätelemään erilaisia keskushermoston neuropsykologisia prosesseja (keskinen 5-HT).Suurin osa 5-HT:sta on kuitenkin keskushermoston ulkopuolella (perifeerinen 5-HT), ja se osallistuu useiden elinjärjestelmien systeemisten ja solubiologisten toimintojen säätelyyn, mukaan lukien sydän- ja verisuonijärjestelmät, keuhkot, maha-suolikanavat, urogenitaaliset ja verihiutaleiden toiminnalliset järjestelmät.5-HT:lla on pitoisuudesta riippuvainen aineenvaihdunta useissa solutyypeissä, mukaan lukien rasvasolut, epiteelisolut ja valkosolut.Perifeerinen 5-HT on myös voimakas immuunimodulaattori, joka voi stimuloida tai estää tulehdusta ja vaikuttaa erilaisiin immuunisoluihin spesifisen 5-HT-reseptorinsa (5HTR) kautta.
HT:n parakriininen ja autokriininen mekanismi
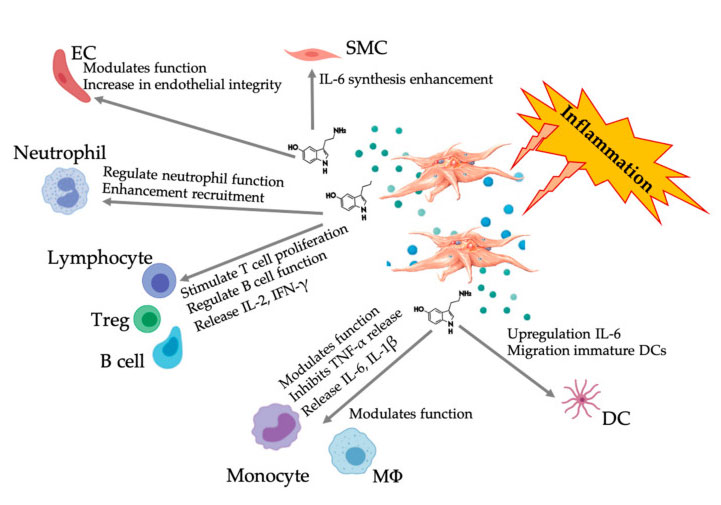
5-HT:n aktiivisuutta välittää sen vuorovaikutus 5HTR:ien kanssa, joka on superperhe, jossa on seitsemän jäsentä (5-HT 1 – 7) ja vähintään 14 erilaista reseptorialatyyppiä, mukaan lukien äskettäin löydetty jäsen 5-HT 7, sen perifeerinen ja toimivat kivunhoidossa.Verihiutaleiden degranulaatioprosessissa aktivoidut verihiutaleet erittävät suuren määrän verihiutaleperäistä 5-HT:tä, joka voi edistää verisuonten supistumista ja stimuloida viereisten verihiutaleiden ja lymfosyyttien aktivaatiota 5-HTR:n ilmentymisen kautta endoteelisoluissa, sileissä lihassoluissa ja immuunisolut.Pacala et ai.Tutkittiin 5-HT:n mitoottista vaikutusta verisuonten endoteelisoluihin ja määritettiin potentiaali edistää vaurioituneiden verisuonten kasvua stimuloimalla angiogeneesiä.Se, miten näitä prosesseja säädellään, ei ole täysin selvää, mutta se voi sisältää erilaisia kaksisuuntaisia signaalireittejä kudoksen mikropiirissä verisuonten endoteelisolujen ja sileän lihassolujen, fibroblastien ja immuunisolujen toimintojen säätelemiseksi näissä soluissa olevien spesifisten 5-HT-reseptorien kautta. .Verihiutaleiden 5-HT:n autokriininen toiminta verihiutaleiden aktivaation jälkeen on kuvattu [REF].5-HT:n vapautuminen tehostaa verihiutaleiden aktivaatiota ja kiertävien verihiutaleiden kerääntymistä, mikä johtaa signaalikaskadireaktioiden ja verihiutaleiden reaktiivisuutta tukevien ylävirran efektorien aktivoitumiseen.
Immunomoduloiva 5-HT-vaikutus
Yhä enemmän todisteita osoittaa, että serotoniinilla voi olla rooli erilaisissa 5HTR:issä immuunimodulaattorina.Tulehdusreaktioon osallistuvissa erilaisissa leukosyyteissä ilmennetyn 5HTR:n mukaan verihiutaleperäinen 5-HT toimii immuunisäätelijänä sekä synnynnäisessä että adaptiivisessa immuunijärjestelmässä.5-HT voi stimuloida Treg-proliferaatiota ja säädellä B-solujen, luonnollisten tappajasolujen ja neutrofiilien toimintoja värväämällä DC:tä ja monosyyttejä tulehduskohtaan.Viimeaikaiset tutkimukset ovat osoittaneet, että verihiutaleperäinen 5-HT voi säädellä immuunisolujen toimintaa tietyissä olosuhteissa.Siksi C-PRP:tä käytettäessä verihiutaleiden pitoisuus on suurempi kuin 1 × 10 6/µL voi merkittävästi auttaa kuljettamaan suurista verihiutaleista peräisin olevan 5-HT:n pitoisuuden kudokseen.Mikroympäristössä, jolle ovat ominaisia tulehdukselliset komponentit, PRP voi olla vuorovaikutuksessa useiden immuunisolujen kanssa, joilla on keskeinen rooli näissä patologioissa, mikä voi vaikuttaa kliinisiin tuloksiin.
Kuva, joka esittää monitahoista 5-HT-vastetta tulehduksellisten PRP-verihiutaleiden aktivoinnin jälkeen.Verihiutaleiden aktivoitumisen jälkeen verihiutaleet vapauttavat rakeensa, mukaan lukien 5-HT tiiviissä rakeissa, jolla on laaja valikoima erilaisia vaikutuksia erilaisiin immuunisoluihin, endoteelisoluihin ja sileisiin lihassoluihin.Lyhenteet: SMC: sileät lihassolut, EC: endoteelisolut, Treg: tavanomaiset T-lymfosyytit, M Φ: makrofagit, DC: dendriittisolut, IL: interleukiini, IFN-γ: interferoni γ. Modifioitu ja mukautettu julkaisusta Everts et ai.ja Hull et ai.
PRP:n analgeettinen vaikutus
Aktivoidut verihiutaleet vapauttavat monia pro-inflammatorisia ja anti-inflammatorisia välittäjiä, jotka voivat paitsi aiheuttaa kipua, myös vähentää tulehdusta ja kipua.Kun PRP:n tyypillinen verihiutaleiden dynamiikka on käytetty, se muuttaa mikroympäristöä ennen kudosten korjausta ja regeneraatiota useiden monimutkaisten anaboliaan ja kataboliaan, solujen lisääntymiseen, erilaistumiseen ja kantasolusäätelyyn liittyvien reittien kautta.Nämä PRP:n ominaisuudet johtavat PRP:n käyttöön erilaisissa kliinisissä patologisissa tiloissa, jotka yleensä liittyvät krooniseen kipuun (kuten urheiluvamma, ortopedinen sairaus, selkärangan sairaus ja monimutkainen krooninen haava), vaikka tarkkaa mekanismia ei ole täysin määritetty.
Vuonna 2008 Evertz et al.Se on ensimmäinen satunnaistettu kontrolloitu tutkimus, joka raportoi PRP-valmisteen kipua lievittävästä vaikutuksesta. PRP valmistetaan ruskeasta kerroksesta autologisen punasolun sedimentaationopeuden perusteella ja aktivoidaan autologisella trombiinilla olkapääleikkauksen jälkeen.He panivat merkille visuaalisen analogisen asteikon pistemäärän merkittävän laskun, opioidipohjaisten kipulääkkeiden käytön ja onnistuneemman postoperatiivisen kuntoutuksen.On huomionarvoista, että ne heijastavat aktivoituneiden verihiutaleiden analgeettista vaikutusta ja spekuloivat 5-HT:tä vapauttavien verihiutaleiden mekanismia.Lyhyesti sanottuna verihiutaleet ovat lepotilassa juuri valmistetussa PRP:ssä.Verihiutaleiden aktivoitumisen jälkeen suoraan tai epäsuorasti (kudostekijä), verihiutaleet muuttavat muotoaan ja tuottavat tarpeeksi vääriä edistääkseen verihiutaleiden aggregaatiota.Sitten ne vapauttavat solunsisäisiä α- ja tiheitä hiukkasia.PGF, sytokiinit ja muut verihiutalelysosomit tunkeutuvat aktivoidulla PRP:llä käsiteltyyn kudokseen.Tarkemmin sanottuna, kun tiheät hiukkaset vapauttavat sisältönsä, ne vapauttavat suuren määrän 5-HT:ta, joka säätelee kipua.C-PRP:ssä verihiutaleiden pitoisuus on 5-7 kertaa suurempi kuin ääreisveren pitoisuus.Siksi 5-HT:n vapautuminen verihiutaleista on tähtitieteellistä.Mielenkiintoista on, että Sprott et ai.Raportissa havaittiin, että kipu helpottui merkittävästi akupunktion ja moksibustion jälkeen, verihiutaleperäisen 5-HT:n pitoisuus pieneni merkittävästi ja 5-HT:n plasmataso nousi.
Perifeerissä verihiutaleet, syöttösolut ja endoteelisolut vapauttavat endogeenistä 5-HT:tä kudosvaurion tai kirurgisen trauman aikana.Mielenkiintoista on, että erilaisia 5-HT-reseptoreita hermosoluista havaittiin perifeerisellä alueella, mikä vahvisti, että 5-HT voi häiritä nosiseptiivista siirtoa perifeerisellä alueella.Nämä tutkimukset osoittavat, että 5-HT voi vaikuttaa perifeeristen kudosten nosiseptiiviseen siirtoon 5-HT1-, 5-HT2-, 5-HT3-, 5-HT4- ja 5-HT7-reseptorien kautta.
5-HT-järjestelmä edustaa tehokasta järjestelmää, joka voi vähentää ja lisätä kipua haitallisen stimulaation jälkeen.Nosiseptiivisten signaalien keskus- ja perifeeristä säätelyä ja muutoksia 5-HT-järjestelmässä on raportoitu potilailla, joilla on krooninen kipu.Viime vuosina suuri määrä tutkimuksia on keskittynyt 5-HT:n ja sen vastaavien reseptorien rooliin haitallisen tiedon käsittelyssä ja säätelyssä, mikä on johtanut lääkkeisiin, kuten selektiivisiin serotoniinin takaisinoton estäjiin (SSRI).Tämä lääke estää serotoniinin takaisinottoa presynaptisiin hermosoluihin serotoniinin vapautumisen jälkeen.Se vaikuttaa serotoniiniviestinnän kestoon ja voimakkuuteen ja on vaihtoehtoinen hoito krooniseen kipuun.Kliinistä lisätutkimusta tarvitaan, jotta ymmärrettäisiin selkeästi PRP-peräisen 5-HT-kivun säätelyn molekyylimekanismi kroonisissa ja rappeutumissairauksissa.
Muita tietoja PRP:n mahdollisen analgeettisen vaikutuksen ratkaisemiseksi voidaan saada kipua lievittävän eläinmallitestin jälkeen.Vertailevat tilastolliset johtopäätökset näissä malleissa ovat haastavia, koska nämä tutkimukset sisältävät liian monia muuttujia.Joissakin kliinisissä tutkimuksissa on kuitenkin käsitelty PRP:n nosiseptiivisia ja analgeettisia vaikutuksia.Useat tutkimukset ovat osoittaneet, että potilailla, jotka saavat hoitoa tendinoosiin tai kiertomansetin repeytymiseen, kipu lievitetään vain vähän.Sitä vastoin useat muut tutkimukset ovat osoittaneet, että PRP voi vähentää tai jopa poistaa kipua potilailla, joilla on jänteen rappeuma, OA, plantaarinen fasciiitti ja muut jalka- ja nilkkasairaudet.Lopullinen verihiutaleiden konsentraatio ja biologinen solukoostumus on tunnistettu tärkeimmiksi PRP-ominaisuuksiksi, jotka auttavat havaitsemaan jatkuvan kipua lievittävän vaikutuksen PRP:n käytön jälkeen.Muita muuttujia ovat PRP:n antotapa, levitystekniikka, verihiutaleiden aktivointiprotokolla, PGF:n ja vapautuneiden sytokiinien biologisen aktiivisuuden taso, PRP-sovelluksen kudostyyppi ja vaurion tyyppi.
On huomionarvoista, että Kuffler ratkaisi PRP:n potentiaalin kivun lievittämisessä potilailla, joilla oli lievä tai vaikea krooninen neuropaattinen kipu, joka on toissijainen vaurioituneen ei-regeneratiivisen hermon vuoksi.Tämän tutkimuksen tarkoituksena on selvittää, voidaanko neuropaattista kipua vähentää tai lievittää PRP:n ansiosta, joka edistää aksonien regeneraatiota ja kohdehermon uudelleenhermotusta.Yllättäen hoitoa saavien potilaiden joukossa neuropaattinen kipu poistuu tai lievittyy vielä vähintään kuuden vuoden kuluttua leikkauksesta.Lisäksi kaikki potilaat alkoivat lievittää kipua kolmen viikon kuluessa PRP:n levittämisestä.
Viime aikoina samanlaisia kipua lievittäviä PRP-vaikutuksia on havaittu postoperatiivisen haavan ja ihonhoidon alalla.Mielenkiintoista on, että kirjoittajat raportoivat haavakivun fysiologisista näkökohdista, jotka liittyvät verisuonivaurioon ja ihokudoksen hypoksiaan.He keskustelivat myös angiogeneesin tärkeydestä hapetuksen ja ravinteiden toimituksen optimoinnissa.Heidän tutkimuksensa osoitti, että verrokkiryhmään verrattuna PRP-hoitoa saaneilla potilailla oli vähemmän kipua ja merkittävästi lisääntynyt angiogeneesi.Lopuksi Johal ja hänen kollegansa suorittivat systemaattisen katsauksen ja meta-analyysin ja päättelivät, että PRP voi vähentää kipua PRP:n käytön jälkeen ortopedisissa indikaatioissa, erityisesti potilailla, jotka saavat ulkoista epikondyliittia ja polven OA-hoitoa.Valitettavasti tässä tutkimuksessa ei täsmennetty valkosolujen vaikutuksia, verihiutaleiden pitoisuutta tai eksogeenisten verihiutaleiden aktivaattorien käyttöä, koska nämä muuttujat vaikuttaisivat PRP:n yleiseen tehokkuuteen.Optimaalinen PRP-verihiutalepitoisuus maksimaalisen kivunlievityksen saavuttamiseksi on epäselvä.Tendinoosin rotan mallissa verihiutaleiden konsentraatio oli 1,0 × 10 6 / μ L:ssä kipu voidaan lievittää kokonaan, kun taas PRP:n aiheuttama kivunlievitys puolella verihiutaleiden pitoisuudesta vähenee merkittävästi.Siksi kannustamme lisää kliinisiä tutkimuksia eri PRP-valmisteiden analgeettisten vaikutusten selvittämiseksi.
PRP ja angiogeneesivaikutus
C-PRP-valmisteet tarkassa regeneratiivisessa lääketieteessä mahdollistavat sellaisten biomolekyylien kuljettamisen, jotka vapautuvat kohdekudoskohdissa aktivoiduista suurista verihiutaleiden pitoisuuksista.Siksi on käynnistetty useita kaskadireaktioita, jotka edistävät paikan päällä tapahtuvaa immuunisäätelyä, tulehdusprosessia ja angiogeneesiä parantamaan ja kudosten korjaamiseen.
Angiogeneesi on dynaaminen monivaiheinen prosessi, joka sisältää itämisen ja kudosten mikrosuonet jo olemassa olevista verisuonista.Angiogeneesi on edennyt useiden biologisten mekanismien ansiosta, mukaan lukien endoteelisolujen migraatio, proliferaatio, erilaistuminen ja jakautuminen.Nämä soluprosessit ovat uusien verisuonten muodostumisen edellytyksiä.Ne ovat välttämättömiä olemassa olevien verisuonten kasvulle verenkierron palauttamiseksi ja kudosten korjauksen ja kudosten uudistumisen korkean metabolisen aktiivisuuden tukemiseksi.Nämä uudet verisuonet mahdollistavat hapen ja ravinteiden kuljettamisen sekä sivutuotteiden poistamisen käsitellyistä kudoksista.
Angiogeneesiaktiivisuutta säädellään stimuloimalla angiogeenistä tekijää VEGF ja antiangiogeenisiä tekijöitä (esim. angiostatiini ja trombospondiini-1 [TSP-1]).Sairaassa ja huonontuneessa mikroympäristössä (mukaan lukien alhainen happipaine, matala pH ja korkea maitohappotaso) paikalliset angiogeeniset tekijät palauttavat angiogeneesiaktiivisuuden.
Useat verihiutaleliukoiset väliaineet, kuten emäksinen FGF ja TGF-β ja VEGF, voivat stimuloida endoteelisoluja tuottamaan uusia verisuonia.Landsdown ja Fortier raportoivat erilaisia tuloksia, jotka liittyvät PRP-koostumukseen, mukaan lukien monien angiogeenisten säätelyaineiden intraverihiutalelähteet.Lisäksi he päättelivät, että angiogeneesin lisääntyminen edistää MSK-taudin paranemista alueilla, joilla on huono vaskularisaatio, kuten meniskin repeämä, jännevaurio ja muut alueet, joilla on huono verisuonitauti.
Edistää ja anti-angiogeenisiä verihiutaleiden ominaisuuksia
Muutaman viime vuosikymmenen aikana julkaistut tutkimukset ovat osoittaneet, että verihiutaleilla on keskeinen rooli primaarisessa hemostaasissa, hyytymien muodostumisessa, kasvutekijän ja sytokiinien vapautumisessa sekä angiogeneesin säätelyssä osana kudosten korjausprosessia.Paradoksaalista kyllä, PRP α- rakeet sisältävät arsenaalin pro-angiogeenisiä kasvutekijöitä, antiangiogeenisiä proteiineja ja sytokiinejä (kuten PF4, plasminogeeniaktivaattori-inhibiittori-1 ja TSP-1), ja ne tähtäävät tiettyjen asiaan vaikuttavien tekijöiden vapautumiseen. .Rooli angiogeneesissä.Siksi PRP:n rooli angiogeneesin säätelyn säätelyssä voidaan määrittää spesifisten solun pinnan reseptorien aktivoitumisena, TGF-β käynnistää pro-angiogeenisiä ja antiangiogeenisiä reaktioita.Verihiutaleiden kyky käyttää angiogeneesireittiä on vahvistettu patologisessa angiogeneesissä ja kasvaimen angiogeneesissä.
Verihiutaleperäinen angiogeeninen kasvutekijä ja antiangiogeeninen kasvutekijä, johdettu α- ja tiheistä ja tarttuvista molekyyleistä.Mikä tärkeintä, on yleisesti hyväksyttyä, että verihiutaleiden kokonaisvaikutus angiogeneesiin on angiogeneesiä edistävä ja stimuloiva.PRP-hoidon odotetaan hallitsevan angiogeneesin induktiota, mikä edistää monien sairauksien, kuten haavan paranemisen ja kudosten korjauksen, hoitovaikutusta.PRP:n antaminen, tarkemmin sanottuna korkean pitoisuuden PGF:n ja muiden verihiutalesytokiinien antaminen, voi indusoida angiogeneesiä, angiogeneesiä ja arteriogeneesiä, koska stroomasoluista peräisin oleva tekijä 1a sitoutuu CXCR4-reseptoriin endoteelisolujen kantasoluissa.Bill et ai.On ehdotettu, että PRP lisää iskeemistä uudissuonittumista, mikä voi johtua angiogeneesin, angiogeneesin ja arteriogeneesin stimulaatiosta.Heidän in vitro -mallissaan endoteelisolujen proliferaatiota ja kapillaarien muodostumista indusoivat monet erilaiset PDG:t, joista VEGF oli tärkein angiogeeninen stimulaattori.Toinen tärkeä ja olennainen tekijä angiogeneesireitin palauttamiseksi on synergia useiden PGF:ien välillä.Richardson et ai.Osoitettiin, että angiogeenisen tekijän verihiutaleperäisen kasvutekijä-bb:n (PDGF-BB) ja VEGF:n synergistinen aktiivisuus johti nopeaan kypsän verisuoniverkoston muodostumiseen verrattuna yksittäisen kasvutekijän aktiivisuuteen.Näiden tekijöiden yhteisvaikutus vahvistettiin äskettäin tutkimuksessa, joka koski aivoverenkierron tehostamista hiirillä, joilla on pitkäaikainen hypoperfuusio.
Mikä tärkeintä, in vitro -tutkimuksessa mitattiin ihmisen napalaskimon endoteelisolujen ja erilaisten verihiutaleiden pitoisuuksien proliferatiivinen vaikutus PRP-valmisteen ja verihiutaleiden annostusstrategian valintaan, ja tulokset osoittivat, että optimaalinen verihiutaleannos oli 1,5 × 106 verihiutaletta/μ 50. Edistää angiogeneesiä.Liian korkea verihiutalepitoisuus voi estää angiogeneesiprosessia, joten vaikutus on huono.
Solujen ikääntyminen, ikääntyminen ja PRP
Solujen vanheneminen voidaan indusoida erilaisilla ärsykkeillä.Tämä on prosessi, jossa solut lopettavat jakautumisen ja läpikäyvät ainutlaatuisia fenotyyppisiä muutoksia estääkseen vaurioituneiden solujen rajoittamattoman kasvun, jolla on tärkeä rooli syövän ehkäisyssä.Fysiologisen ikääntymisen prosessissa solujen replikaation ikääntyminen edistää myös solujen ikääntymistä ja MSC-solujen regeneraatiokyky heikkenee.
Ikääntymisen ja solujen ikääntymisen vaikutukset
In vivo monet solutyypit vanhenevat ja kerääntyvät eri kudoksiin ikääntymisen aikana, joiden joukossa on suuri määrä ikääntyviä soluja.Ikääntyvien solujen kerääntyminen näyttää lisääntyvän iän, immuunijärjestelmän vaurioiden, kudosvaurioiden tai stressiin liittyvien tekijöiden myötä.Solujen ikääntymisen mekanismi on tunnistettu ikään liittyvien sairauksien, kuten nivelrikon, osteoporoosin ja nikamien välisen rappeuman, patogeeniseksi tekijäksi.Erilaiset ärsykkeet pahentavat solujen ikääntymistä.Vasteena vanhenemiseen liittyvä eritysfenotyyppi (SASP) erittää korkeita pitoisuuksia proteiinisoluja ja sytokiinejä.Tämä erityinen fenotyyppi liittyy ikääntyviin soluihin, joissa ne erittävät korkeita määriä tulehduksellisia sytokiinejä (kuten IL-1, IL-6, IL-8), kasvutekijöitä (kuten TGF-β、 HGF, VEGF, PDGF), MMP ja katepsiini.Verrattuna nuoriin SAPS:n on osoitettu lisääntyvän iän myötä, koska vakaan tilan prosessi tuhoutuu, mikä johtaa solujen ikääntymiseen ja uusiutumiskyvyn heikkenemiseen.Erityisesti nivelsairauksissa ja luustolihassairauksissa.Tässä suhteessa immuunijärjestelmän ikääntymisen katsotaan olevan merkittävä muutos immuunisolujen eritysspektrissä, mikä osoittaa, että TNF-a:n, IL-6:n ja/tai Il-1b:n pitoisuus kasvaa, mikä johtaa matala-asteiseen krooniseen tulehdukseen.On syytä huomata, että kantasolujen toimintahäiriö liittyy myös ei-sellulaarisiin autonomisiin mekanismeihin, kuten solujen ikääntymiseen, erityisesti tulehdusta edistävien ja antiregeneratiivisten tekijöiden tuotantoon SASP:n kautta.
Päinvastoin, SASP voi myös stimuloida solujen plastisuutta ja viereisten solujen uudelleenohjelmointia.Lisäksi SASP voi järjestää kommunikaatiota erilaisten immuunivälittäjien kanssa ja aktivoida immuunisoluja ikääntyvien solujen puhdistuman edistämiseksi.Ikääntyvien solujen roolin ja toiminnan ymmärtäminen edistää MSK-lihasten ja kroonisten haavojen paranemista ja kudosten uudistumista.
On huomionarvoista, että Ritcka et ai.Laajassa tutkimuksessa selvitettiin SASP:n tärkein ja hyödyllinen rooli soluplastisuuden ja kudosten uusiutumisen edistäjänä sekä otettiin käyttöön käsite ikääntyvien solujen ohimenevä hoito.He mainitsivat varovasti, että ikääntyminen on pääasiassa hyödyllinen ja uudistava prosessi.
Solujen ikääntyminen ja PRP:n potentiaali
Kun kantasolujen määrä vähenee, ikääntyminen vaikuttaa kantasolujen suorituskykyyn.Samoin ihmisillä kantasolujen ominaisuudet (kuten kuivuus, lisääntyminen ja erilaistuminen) heikkenevät iän myötä.Wang ja Nirmala raportoivat, että ikääntyminen vähentäisi jännesolujen kantasolujen ominaisuuksia ja kasvutekijäreseptorien määrää.Eläintutkimus osoitti, että PDGF:n pitoisuus nuorilla hevosilla oli korkea.He päättelivät, että GF-reseptorien määrän ja GF:n määrän kasvu nuorilla yksilöillä saattaa saada paremman soluvasteen PRP-hoitoon kuin vanhemmilla yksilöillä nuorilla yksilöillä.Nämä havainnot paljastavat, miksi PRP-hoito voi olla vähemmän tehokasta tai jopa tehotonta iäkkäillä potilailla, joilla on vähemmän kantasoluja ja "huono laatu".On todistettu, että ikääntyvän ruston ikääntymisprosessi kääntyy ja rustosolujen lepoaika pitenee PRP-injektion jälkeen.Jia et ai.Sitä käytetään hiiren ihon fibroblastien valovanhenemisen tutkimiseen in vitro PRP-käsittelyn kanssa ja ilman PGF-vastavaikutuksen mekanismin selventämiseksi tässä mallissa.PRP-ryhmä osoitti suoraa vaikutusta solunulkoiseen matriisiin, lisäsi tyypin I kollageenia ja vähensi metalloproteinaasien synteesiä, mikä osoittaa, että PRP voi estää solujen ikääntymisen ja myös rappeuttavassa MSK-taudissa.
Toisessa tutkimuksessa PRP:tä käytettiin ikääntyneiden luuytimen kantasolujen keräämiseen vanhoista hiiristä.On todettu, että PRP voi palauttaa erilaisia kantasolutoimintoja ikääntymisestä, kuten solujen lisääntymisen ja pesäkkeiden muodostumisen, sekä rekonstruoida solujen ikääntymiseen liittyviä markkereita.
Oberlohr ja hänen kollegansa tutkivat äskettäin laajasti solujen ikääntymisen roolia lihasten regeneraation heikkenemisessä ja arvioivat PRP:tä ja verihiutalehuonoa plasmaa (PPP) biologisina hoitovaihtoehtoina luustolihasten korjaamiseksi.He kuvittelivat, että PRP- tai PPP-hoito luurankolihasten korjaamiseksi perustuisi SASP-spesifisille solumarkkereille räätälöityihin biologisiin tekijöihin ja muihin tekijöihin, jotka johtavat fibroosin kehittymiseen.
On perusteltua uskoa, että ennen PRP:n käyttöä kohdennettu solujen ikääntyminen voi parantaa biologisen hoidon tehokkuuden regeneraatioominaisuuksia vähentämällä paikallisia SASP-tekijöitä.On ehdotettu, että toinen vaihtoehto PRP- ja PPP-hoidon tulosten parantamiseksi luurankolihasten uudistamiseksi on ikääntyvien solujen valikoiva poistaminen ikääntyvien scavenger-aineiden avulla.Ei ole epäilystäkään siitä, että viimeaikaiset tutkimustulokset PRP:n vaikutuksesta solujen ikääntymiseen ja ikääntymiseen ovat kiehtovia, mutta ne ovat vielä alkuvaiheessa.Siksi on kohtuutonta tehdä mitään ehdotuksia tällä hetkellä.
(Tämän artikkelin sisältö on painettu uudelleen, emmekä anna mitään nimenomaista tai epäsuoraa takuuta tämän artikkelin sisällön tarkkuudesta, luotettavuudesta tai täydellisyydestä, emmekä ole vastuussa tämän artikkelin mielipiteistä, ymmärrä.)
Postitusaika: 01.03.2023